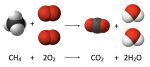
Định luật bảo toàn khối lượng được phát biểu thế nào? Được ứng dụng trong ngành khoa học nào? Cùng Mamnonabc.vn tìm hiểu trong bài viết này nhé!
Định luật bảo toàn khối lượng
Định luật bảo toàn khối lượng còn được gọi là định luật Lomonosov – Lavoisier, là một định luật cơ bản trong hóa học.
Định luật phát biểu như sau: Trong một phản ứng hóa học, tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng sản phẩm tạo thành.

Lịch sử ra đời của Định luật
Định luật bảo toàn khối lượng được hai nhà khoa học là Mikhail Vasilyevich Lomonosov và Antoine Lavoisier khám phá ra trong quá trình nghiên cứu độc lập, thực hiện với các thí nghiệm được cân đo chính xác. Theo đó, năm 1748, Mikhail Vasilyevich Lomonosov đặt ra định đề, năm 1789 Antoine Lavoisier phát biểu định luật này.
Lomonosov trình bày định luật này như sau: “Tất cả những biến đổi xảy ra trong tự nhiên có bản chất là nếu lấy đi bao nhiêu ở vật thể này, thì có bấy nhiêu được thêm vào ở vật thể khác. Như vậy, ở đây giảm đi bao nhiêu vật chất thì sẽ có từng ấy vật chất tăng lên ở chỗ khác”.
Bản chất của Định luật
Bản chất của định luật được giải thích như sau: Sự thay đổi liên kết giữa các nguyên tử sẽ xảy ra trong mỗi phản ứng hóa học, tuy nhiên, sự thay đổi này chỉ liên quan đến điện tử, còn số nguyên tử của mỗi nguyên tố được giữ nguyên, đồng thời khối lượng của các nguyên tử sẽ không đổi. Vì thế, tổng khối lượng các chất vẫn được bảo toàn.
Định luật này còn được gọi là Định luật bảo toàn khối lượng của các chất, bởi lẽ cùng một thời điểm thì trọng lượng tỉ lệ thuận với khối lượng. Theo Lomonosov, việc bảo toàn năng lượng cũng có giá trị khá lớn đối với các phản ứng hóa học.
Công thức Định luật bảo toàn khối lượng
Định luật có cách tính chung như sau: Trong trường hợp một phản ứng giữa A + B tạo ra C + D, biết khối lượng được ký hiệu là m, công thức tính Định luật sẽ được thể hiện là mA + mB = mC + mD.
Chẳng hạn, phản ứng BaCl2 + Na2SO4 → BaSO4 + 2NaCl sẽ có công thức định luật bảo toàn khối lượng như sau: mBaCl2 + mNa2SO4 = mNaCl + mBaSO4.
Ngoài ra, trong một phản ứng có n chất, biết khối lượng của (n – 1) chất ta sẽ tính được khối lượng của chất còn lại.
Bài tập về Định luật bảo toàn khối lượng
Câu 1. Trong một phản ứng hóa học, khối lượng của Na2SO4 là 14.2g, khối lượng sản phẩm BaSO4 là 23.3g và NaCl là 11.7g. Khối lượng BaCl2 đã phản ứng là bao nhiêu?
Hướng dẫn giải
Phương trình phản ứng: BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Định luật bảo toàn khối lượng:
mBaCl2 + mNa2SO4 = mBaSO4 + mNaCl
→ mBaCl2 = mBaSO4 + mNaCl – mNa2SO4
→ mBaCl2 = 23.3 + 11.7 – 14.2 = 20.8 (g)
Câu 2. Đốt cháy hết 9g kim loại Mg trong không khí thu được 15g MgO. Biết rằng Mg cháy xảy ra phản ứng với O2 trong không khí.
Hướng dẫn giải
Phương trình phản ứng: Mg + O2 → MgO
Công thức về khối lượng của phản ứng: mMg + mO2 = mMgO
Định luật bảo toàn khối lượng:
mO2 = mMgO – mMg
→ mO2 = 15 – 9 = 6 (g).
Câu 3. Đốt cháy 4g chất A cần 12,8g khí oxy, kết quả thu được khí CO2 và hơi nước theo tỉ lệ mCO2 : mH2O = 11 : 3. Tính khối lượng CO2 và H2O.
Hướng dẫn giải
Gọi khối lượng của H2O và CO2 lần lượt là 3a và 11a. Theo định luật bảo toàn khối lượng ta có:
mA + mO2 = mCO2 + mH2O
→ 4 + 12.8 = 11a + 3a
→ 16.8 = 14a
→ a = 1.2
→ mCO2 = 11 x 1.2 = 13.2g, mH2O = 3 x 1.2 = 3.6g.
Câu 4. Khi nung đá vôi tới 90% khối lượng (bằng phần trăm chứa canxi cacbonat) ta thu được 11.2 tấn canxi oxit và 8.8 tấn cacbonic. Khối lượng đá vôi lấy đem nung là bao nhiêu?
Hướng dẫn giải
CaCo3 → (to) CaO + CO2
Định luật bảo toàn khối lượng:
mCaCo3 = mCaO + mCo2
→ mCaCo3 = 11.2 + 8.8 = 20 tấn.
Khối lượng đá vôi đã đem nung là (20/90)x100 = 22,22 tấn.
Trên đây là các thông tin chi tiết về Định luật bảo toàn khối lượng, cảm ơn bạn đã theo dõi bài viết.
>> Xem thêm: dòng điện không đổi là gì?